|
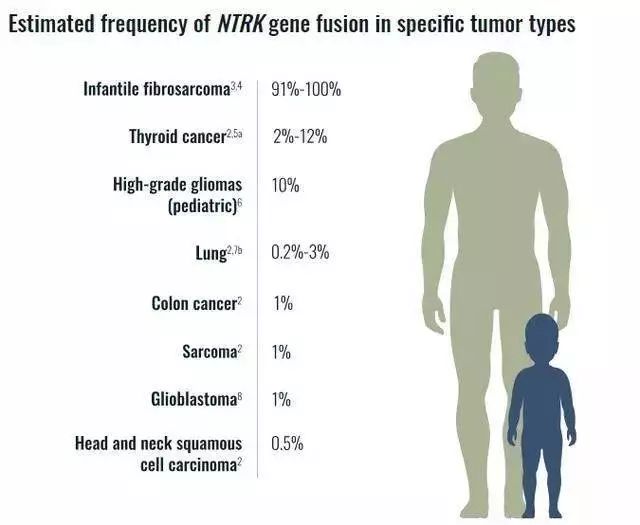
本文来自微信公众号:果壳(ID:Guokr42),作者:MarvinP,编辑:odette,李小葵 不久之前,“治愈率达到75%的广谱抗癌药上市”的消息四处传播,引发喜大普奔。 喜大的是群众,普奔的是跟在后面辟谣的科普众,他们在忙着替新闻里的抗癌药拉罗替尼呼喊:我没有,我不是,我的“广谱”要有限定词。 这款药物没有新闻标题里说的那么神奇,但它背后体现的进步依然足够激动人心: 它标志着人类对癌症的治疗进入了按生物标记物而不是按组织来施治的时代,也是近年出现的“篮子试验”再次大放异彩的明证,同时暗示了精准医疗可能为罕见病患者带来的福音。 有限的“广谱”药,是罕见病患者梦寐以求的福音 首先要确定的是,拉罗替尼的确是经过临床试验评估和行政审批通过的正经抗癌药。只不过“75%”指的是“整体缓解率”,离“治愈”还有不小差距。 “广谱”这个词也要加引号,因为虽然适用于多种癌症,但拉罗替尼是精确得像手术刀一样的靶向药,专门打击癌症中整体占比并不高的特定突变类型。 但不要因此就小看拉罗替尼。 首先,75%的整体缓解率包括了22%的完全缓解(肿瘤消失)和53%的部分缓解(肿瘤缩小),对于一种作为单独疗法的新型口服抗癌药来说,这是足以自豪的成就——乳腺癌明星药物赫赛汀在目标患者中的整体缓解率约为26%,靶向药代表格列卫在最严重的急性变期慢性髓细胞性白血病(CML)患者中的整体缓解率约为55%,它们都已是在癌症治疗领域改天换地的救命药。可以想象,新药拉罗替尼也应能独当一面,给无数患者及家庭带来福音。 其次,拉罗替尼针对的突变(NTRK融合)虽然只占全部癌症中的大约千分之二,但这种突变在某些罕见癌症中却很常见。拉罗替尼是种“组织不定”的疗法,意味着不看肿瘤发源组织,只看肿瘤分子特性,符合条件就可以考虑用拉罗替尼治疗。NTRK融合虽然不是常见癌症中最主要的突变,但却是某些罕见癌症的驱动基因——它在肺癌中不超过3%,结直肠癌中约为1%,但在婴儿纤维肉瘤中占比高达91% ~100%!
具有NTRK基因融合的癌症在不同癌症中所占的比例,第一条即为婴儿纤维肉瘤。如果患者想知道药物是否适合自己,需要通过基因检测看是否含有该突变丨trkcancer.com 能凭借分子特性而不靠组织来源来施药,是罕见癌症的一大喜讯。 罕见病药物的临床开发一向很难,原因之一是市场小,研发动力不足;之二是患者少,进行临床试验困难。 像先天性肾瘤、婴儿纤维肉瘤、唾液腺癌和乳腺样分泌癌(MASC)等多种罕见癌症常被研发界忽视,但它们共享着NTRK融合的特征,这次拉罗替尼获批,对这些疾病的患者是极有意义的好消息。 而罕见病患者能这么快用上新药,要归功于“篮子试验”这种新出现的临床试验设置,扩大了新药可用的适应症。
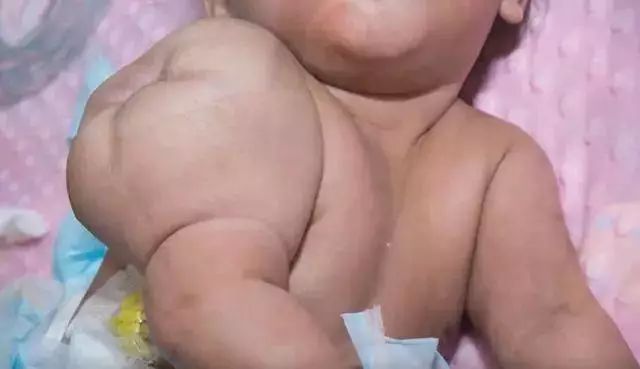
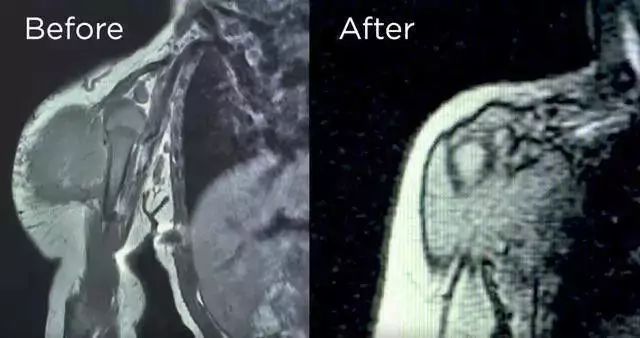
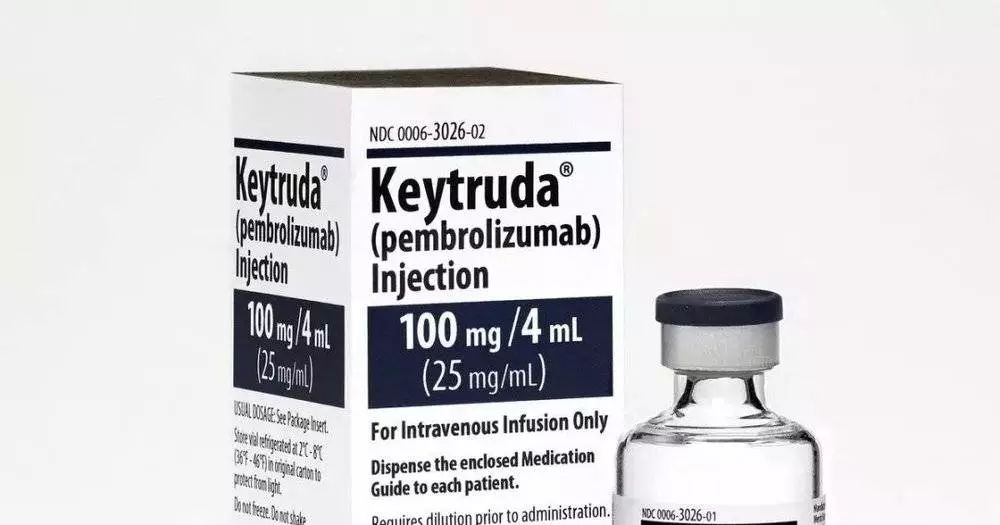
在纽约斯隆-凯特琳纪念医院肿瘤中心(MSKCC)接受拉罗替尼治疗的女童,治疗前她的右臂有个比脸还大的婴儿纤维肉瘤,治疗后她的肿瘤消失,笑容出现丨MSKCC的视频截图 精准医疗,让每位癌症患者找到适合自己的药 1999年,格列卫的临床试验结果公布,其在特定患者群中能达到100%的血液学缓解和45%的细胞遗传学缓解,举世皆惊。癌症治疗界从此开启靶向药时代。 而今年拉罗替尼获批,正如FDA局长所说,这“标志着人们在癌症治疗又迈出了一步,治疗时的关注点从癌症产生的部位转向驱动癌症的遗传原因”。 拉罗替尼可以算是第一个“广谱”靶向药物,也是FDA批准的第二个“组织不定”疗法。之前FDA曾经批准过一款“广谱”免疫药物,即派姆单抗(Keytruda),可以用于不分肿瘤来源的两种生物标志物阳性的实体瘤患者。与拉罗替尼不同的是,派姆单抗针对的不是肿瘤本身的驱动机制,而是旨在调节患者的免疫系统,让其对肿瘤发动攻击。
派姆单抗丨Mesothelioma Help 生物标记物、靶向疗法,这些都是近些年发展起来的“精准医疗”的特征。精准医疗是指根据每个个体的遗传信息、生活环境和生活方式来决定医疗方案和预防措施。 虽然“精准医疗”这个词比较新,但其内涵却源远流长——按血型输血就可以算是一种精准医疗。说它精准,是与传统治疗相比。 传统的治疗是将患者看作平均值,差不多的病情都吃差不多的药,开差不多的刀。但人们对疾病的了解日益深入,逐渐发现这种求同不存异的方法效果不大好:即使是始发于同一种组织的癌症之间也可能天差地别:三阴乳腺癌和三阳乳腺癌的分子特征和预后都不相同,小细胞肺癌和非小细胞肺癌的成因和转移性也有巨大区别。在这个年代,连表情符号都能按个人脸孔订制,难道治疗癌症还是靠一刀切(比喻意,同时也是字面意),让化疗无差别攻击?
我们应该有更多的方式去了解病患丨pixabay 所以需要精准医疗的靶向疗法,利用药物来鉴别和攻击特定类型的癌细胞,并尽量减少对正常细胞的影响。最常见的靶向疗法针对促进细胞分裂和迁移的蛋白或者分子信号,利用癌细胞和正常细胞之间的窗口差,杀灭更依赖这些蛋白的癌细胞。如果能对症,靶向疗法的副作用可能会比化疗小。 拉罗替尼所针对的NTRK融合突变,就是本来调控细胞生长、增殖和存活的TRK蛋白过于活跃导致癌症。对这些过于活跃的突变蛋白进行抑制,犹如修剪旁逸斜出的过长树枝,而不损伤正常生长的枝干。 为了能让靶向疗法起效,需要了解患者的分子特征,特别是肿瘤的特异性分子(生物标记物)。 在个人基因组测序比一顿大餐还便宜的时代,个人遗传信息、电子化病历等信息都越来越易获得,也为精准医疗提供了基础,并催生了“篮子试验”和“雨伞试验”这些新时代临床试验设置,拉罗替尼是“篮子试验”的成功范例。 把不同的患者放进一个“篮子”,加速药物研发 抗癌新药的诞生是相当艰难的。 当研究者找到一种有抗癌潜力的物质,会首先在癌细胞系中测试其有效性,然后进行动物实验测试生物活性和安全性,如果没有发现不可接受的毒性,就可以考虑在人体中进行临床试验。 临床试验一般分成四期。 1,一期是测试不同剂量的药物在人体内的毒性,这个阶段只包括少数患者; 2,如果药物能通过一期测试,二期就会测试其药效和进一步评估安全性,这个阶段会招募几十至上百名患有相同组织癌症的患者,采用一期所显示的最安全和有效的剂量进行治疗; 3,如果患者能从这阶段获得临床收益,那么药物有望进入三期,和现有的常规护理方法进行比较。三期会有数百甚至上千的患者参与;如果药物在三期中展现出优于现有疗法的药效,研究者就可以向FDA提出新药的审批申请; 4,即使在FDA批准某新药上市之后,很长的一段时间内它还会处于临床四期的评估中,进一步接受关于药物未知作用的评估。 在实验室中有效的物质多如过江之鲫,但真正能通过临床试验获批的寥寥无几——近期有篇文章统计了过去20年中阿茨海默症的药物开发,发现成功与失败的比例为1:37,失败的药物大部分都败退在耗资颇巨的临床开发后期。临床试验的风险和压力可见一斑。 虽然癌症药物与阿茨海默症的药物机理和试验方法都不同,但亦是千辛万苦百里挑一。 研发罕见癌症药物面临的考验就更大。考虑到资金、资源和时间的风险,以及能参与试验的患者人数稀少,许多研发者不大愿意开发罕见病的药物。 为了解决这个问题,在政策方面,FDA已经在资金和审批方面提供了许多优惠;而受试患者稀少的限制,则有望能被近年出现的“篮子试验”缓解。
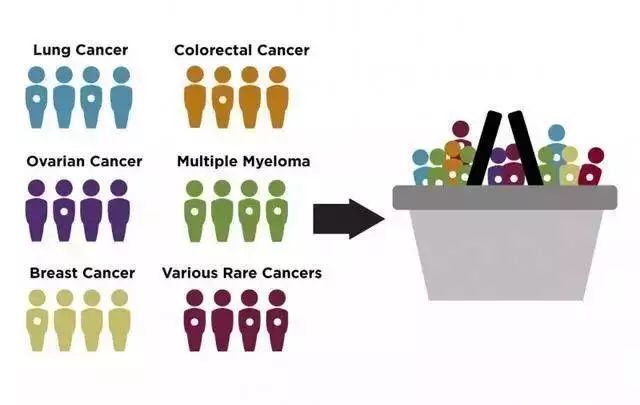
篮子试验图示:肺癌、结直肠癌、卵巢癌、多发性骨髓瘤、乳腺癌和其他罕见癌症患者,他们中有部分都具有某类特定突变(空心点),篮子试验将这些患者集合到一起进行测试,而不采用一次只测一种组织的传统方式丨MSKCC “篮子试验”是集合不同组织和器官的肿瘤患者,同时测试针对一种突变的一种药物。2015年一篇发表在《新英格兰医学杂志》的论文首次报道了这种试验方案。 这项临床二期试验测试了靶向药维罗非尼对于具有BRAF V600突变的肿瘤的效果。维罗非尼在2011年获批用于治疗具有BRAF突变的黑色素瘤,效果超群。但除了黑色素瘤,也有其他癌症包括这一突变,于是研究者想,维罗非尼会不会对这些癌症也有效呢? 如果按传统的临床试验方法,其他癌症要分组织一个接一个地测,排到罕见病的时候可能患者都不在了……既然有基因检测技术加持,那么完全可以给肿瘤患者测个序,如果有这种突变,就划归到篮子里一起测试,看靶向药的效果如何。 这个试验可以回答,靶向药是对所有具有这类突变的癌组织都有效呢,还是说各个组织的不同生理特性和微环境会让药只在某一类组织中有用武之地呢? 这项试验招募了122名患者,涉及十几种不同癌症,并且都通过基因检测确定是BRAF V600突变阳性。结果显示,维罗非尼在多种肿瘤患者中都产生了缓解作用,但效果不一,在非小细胞肺癌、埃德海姆⁃切斯特病(Erdheim-Chester disease,ECD)和朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis)中效果最好,缓解率超过40%——后两种都是罕见病。 这个结果鼓舞人心:靶向药果然对具有特定突变的癌症有效果,即使组织不同也有发挥药效的潜力。 基于这个试验和后续结果,FDA在2017年11月扩大了维罗非尼的适应症,批准其治疗BRAF V600突变阳性的ECD。维罗非尼是FDA批准的首个ECD疗法。 因为这种病非常罕见,全世界只有不到1000名患者,所以在此之前未得到大规模研究,也缺乏专门的疗法。如果不是篮子试验,这些患者很可能在很长时间内都无药可用。而篮子试验能在很大程度上减小开发者的风险,并提升临床试验的可行性。 传统的临床试验方案对于罕见病患者效率很低,新的试验设置可能加快新疗法的产生过程。 2015年维罗非尼篮子试验论文的第一作者海曼博士(David Hyman),也是这次拉罗替尼篮子试验的研究主持人,他评价拉罗替尼获批的消息时说:“我们现在有了针对(NTRK融合)突变的第一种药物,而不用去区分癌症种类……这种药让我们见识到精准医学的真实潜力。” 精准医学的真实潜力,就是让每个人的每种疾病都有为其量身打造的疗法。当年格列卫面世时,研究者的愿景是“每种癌症都有种格列卫”,而现在随着科学进步,似乎能更进一步达到“每个患者的每种疾病都有几种量身定做的疗法”。 虽然现在我们还在路上,目的地尚未到达,但似乎已经望得见了。而且多亏了精准医疗,让罕见病患者不会因为人少而被丢在半途。 主要参考文献: [1]Vogel CL et al., First-line Herceptin monotherapy in metastatic breast cancer. Oncology, 2001,DOI: doi.org/10.1159/000055400 [2]Druker BJ et al., Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med., 2001, DOI: 10.1056/NEJM200104053441402 [3]Gatalica Z et al., Abstract A047: Molecular characterization of the malignancies with targetable NTRK gene fusions, AACR, 2017, DOI: 10.1158/1535-7163 [4]Doebele RC et al., An Oncogenic NTRK fusion in a patient with soft-tissue sarcoma with response to the tropomyosin-related kinase inhibitor LOXO-101, Cancer Discovery, 2015, DOI: 10.1158/2159-8290 [5]Hyman DM et al., Vemurafenib in multiple nonmelanoma cancers with BRAF V600 mutations, N Engl J Med., 2015, DOI: 10.1056/NEJMoa1502309. [6]Drilon A et al., Efficacy of Larotrectinib in TRK fusion-positive cancers in adults and children, N Engl J Med., 2018, DOI: 10.1056/NEJMoa1714448 本文来自微信公众号:果壳(ID:Guokr42),作者:MarvinP,编辑:odette,李小葵
虎Cares 「职场温暖供应商」虎Cares 为您带来今日天气播报:
西北风转东南风风力强劲 |
- © 2019 备案老域名(yumi66.com) 鲁ICP备17066565号